European Authorized Representative (EC REP)
European Authorized Representative for Medical Devices (MDR (EU) 2017/745) and In Vitro Diagnostic Devices (IVDR (EU) 2017/746)
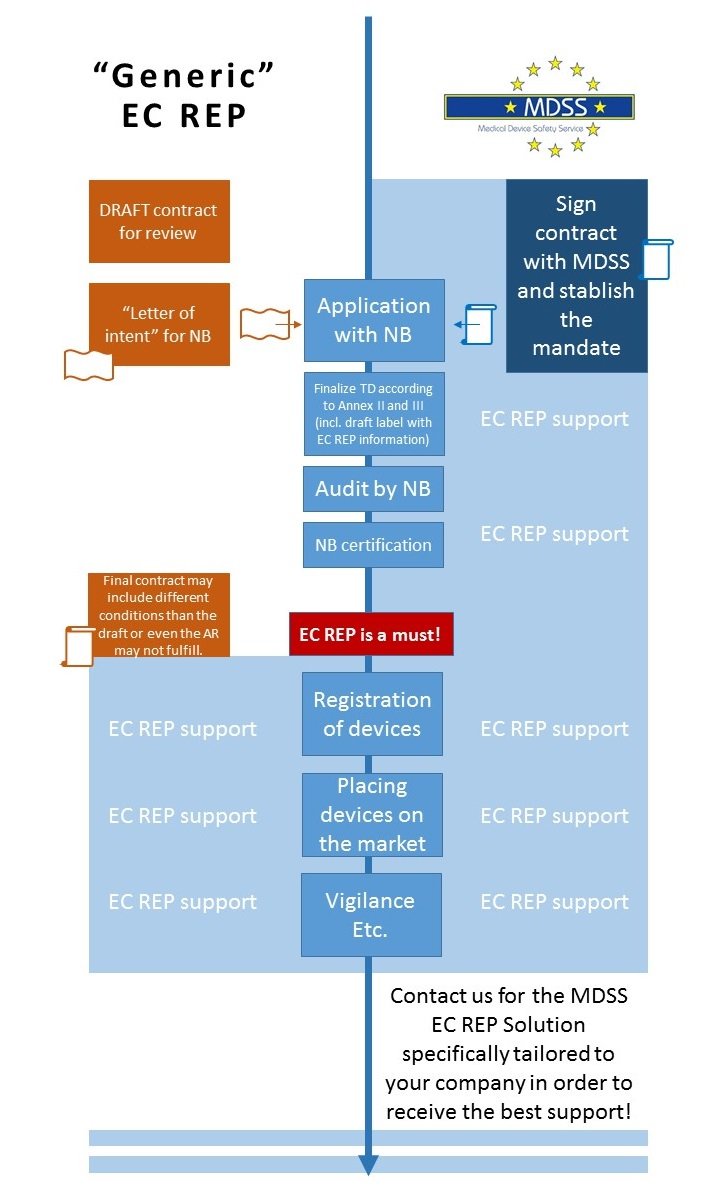
The appointment of an European Authorized Representative ( EC REP) for the Member States of the EEA is a requirement of the EuropeanMedical Device Regulations — Medical Device Regulation (MDR (EU) 2017/745) and In Vitro Diagnostic Medical Device Regulation (IVDR (EU) 2017/746), to fulfill one aspect of the requirements for CE marking.
The importance of a European Authorized Representative (EC REP)?
The European Authorized Representative (EC REP) performs certain duties under the European Medical Devices Regulations and acts as the legal interface between the Medical Device manufacturer and the EU Authorities. Appointing MDSS as your EC REP will set your company on the forefront of European Regulatory Requirements. We meet the full EU criteria for CE marking and, most importantly, MDSS has the log-term experience in Regulatory Affairs to provide this demanding and `highly responsible´ Authorized Representative service!
When to designate the Authorized Representative?
We say: from the start! Ensure a smooth and efficient process!
Ec rep что означает маркировка
Определение Директив ЕС, требованиям которых должна соответствовать продукция:
93/42/ЕЭС – для медицинских изделий (MDD) or 90/385/ЕЭС — для активных имплантируемых медицинских изделий (AIMDD).
Определение классификации продукции с помощью приложения IX Директиву для медицинских изделий (MDD):
Класс I (нестерильные, без фунции измерения),Класс I (стерильные, с фунцией измерения),Класс IIa,Класс IIb или Класс III/AIMD*.
* Активные имплантируемые медицинские изделия подлежат тем же нормативными требованиями как изделия Класса III
Для всех устройств, кроме Класса I (нестерильные, без функции измерения), осуществить Систему Менеджмента Качества (СМК),
в соответствии с Приложением II или Приложением V директивы MDD.
Для продуктов Класса III/AIMD, подготовить Дизайн Досье (Design Dossier*).
Для всех остальных устройств, подготовить ЕС Технический файл, который содержит подробную информацию подтверждающую соответствие медицинского изделия
директиве MDD 93/42/ЕЭС.
* Для устройств Класса III / AIMD будут необходимыми данные клинического исследования. Клинические испытания в Европе должны быть предварительно одобрены европейским нотифицированным органом.
Назначить Европейского Авторизованного Представителя (EC REP), который расположенный в Европе.
Поместить название и адрес ЕС REP в инструкции по применению и на упаковке.
Авторизованный
Представителт
Для всех устройств, кроме Класса I (нестерильные, без функции измерения),
Ваша СМК и Технический Файл или Дизайн Досье должны пройти проверку Нотифицированным Органом, который является третьей стороной, аккредитованной Европейскими властями для оценки медицинских изделий и компаний — производящих продукты медицинского назначения.
Подготовка Декларации Соответствия, которая является документом имеющим обязательную юридическую силу, подготовленным изготовителем с указанием,
что устройство соотвечает приенимым Директивам.
Для всех медицинских изделий и средств IVD в Европейском Союзе, сертификат CE является необходим. Эта сертификация подтверждает, что устройство соответствует всем нормативным требованиям «Медицинских Директив».
Ec rep что означает маркировка
Определение Директив ЕС, требованиям которых должна соответствовать продукция:
93/42/ЕЭС – для медицинских изделий (MDD) or 90/385/ЕЭС — для активных имплантируемых медицинских изделий (AIMDD).
Определение классификации продукции с помощью приложения IX Директиву для медицинских изделий (MDD):
Класс I (нестерильные, без фунции измерения),Класс I (стерильные, с фунцией измерения),Класс IIa,Класс IIb или Класс III/AIMD*.
* Активные имплантируемые медицинские изделия подлежат тем же нормативными требованиями как изделия Класса III
Для всех устройств, кроме Класса I (нестерильные, без функции измерения), осуществить Систему Менеджмента Качества (СМК),
в соответствии с Приложением II или Приложением V директивы MDD.
Для продуктов Класса III/AIMD, подготовить Дизайн Досье (Design Dossier*).
Для всех остальных устройств, подготовить ЕС Технический файл, который содержит подробную информацию подтверждающую соответствие медицинского изделия
директиве MDD 93/42/ЕЭС.
* Для устройств Класса III / AIMD будут необходимыми данные клинического исследования. Клинические испытания в Европе должны быть предварительно одобрены европейским нотифицированным органом.
Назначить Европейского Авторизованного Представителя (EC REP), который расположенный в Европе.
Поместить название и адрес ЕС REP в инструкции по применению и на упаковке.
Авторизованный
Представителт
Для всех устройств, кроме Класса I (нестерильные, без функции измерения),
Ваша СМК и Технический Файл или Дизайн Досье должны пройти проверку Нотифицированным Органом, который является третьей стороной, аккредитованной Европейскими властями для оценки медицинских изделий и компаний — производящих продукты медицинского назначения.
Подготовка Декларации Соответствия, которая является документом имеющим обязательную юридическую силу, подготовленным изготовителем с указанием,
что устройство соотвечает приенимым Директивам.
Для всех медицинских изделий и средств IVD в Европейском Союзе, сертификат CE является необходим. Эта сертификация подтверждает, что устройство соответствует всем нормативным требованиям «Медицинских Директив».
CE-маркировка — регуляторные процессы Европейского Союза для медицинских изделий
*Продукция классов IIb и III с большой вероятностью потребует большого количества клинических данных. В ряде случаев могут использоваться существующие научные данные, но нередко требуется проведение клинических исследований. Клинические исследования, проводимые в ЕС должны быть одобрены Европейскими регуляторными агентствами. Планы и отчеты по клиническим испытаниям помещаются в соответствующий раздел технической документации.
**Нотифицированная Организация — организация, аккредитованная Европейским Союзом на контроль над производителями продукции медицинского назначения.
***CE-Сертификат не выдается продуктам класса I (нестерильным, без функции измерения), поскольку для медицинских изделий данного класса соответствие требованиям Регламента ЕС 2017/745 заявляется производителем в порядке самодекларации.
Скачать брошюру «CE-маркировка для медицинских изделий» в PDF-формате
Как зарегистрировать медицинское изделие в ЕС. Читать статью.
MDRC помогает производителям изделий медицинского назначения достичь соответствия регуляторным требованиям Европейского Союза, зарегистрировать и вывести на европейский рынок их продукцию.
Классификация изделий медицинского назначения
В ЕС определение класса изделий медицинского назначения осуществляется на основе ряда правил, изложенных в приложении VIII Регламента ЕС 2017/745. Поэтому медицинский продукт определенного класса по классификации РФ, США, Китая или другой страны, не входящей в Европейский Союз, в ЕС может относиться к другому классу продукции. Правильное определение класса вашей продукции является критически важным, поскольку от класса будет зависеть то, каким образом будет осуществляться регистрация и вывод на рынок ваших продуктов. Мы поможем вам правильно классифицировать вашу продукцию.
Обучение: CE-маркировка и регуляторная система ЕС для медицинских изделий
Технические файлы и досье разработки
Наличие технического файла является обязательным требованием ЕС, независимо от класса и типа продукта. Досье разработки обязательны для продуктов класса III. Досье разработки отличаются от технических файлов рядом дополнительных требований — в частности необходимостью обширной клинической программы. Мы создали многочисленные технические файлы и досье разработки для целого ряда различных продуктов и готовы помочь вам в создании технической и клинической документации для вашей продукции. Кроме того, мы проводим клиническую оценку продукции, разрабатываем инструкции по применению изделий медицинского назначения и помогаем добиться соответствия ISO 14971.
ISO 13485 и система менеджмента качества (СМК)
У MDRC имеются готовые процедуры и шаблоны документов, которые соответствуют регуляторным требованиям большинства стран и которые могут быть имплементированы в любой компании. Большинство компаний предпочитают использовать стандарт ISO 13485. Мы готовы помочь вам с внедрением СМК. Если у вас уже имеется СМК, мы поможем вам добиться ее соответствия европейским требованиям.
MDR (EU 2017/745) и IVDR (EU 2017/746) требуют наличия у производителя медицинских изделий PRRC (Person Responsible for Regulatory Compliance).
Авторизованное представительство в ЕС (EC REP)
Компании, находящиеся вне Европейского Союза, должны назначить Авторизованного Представителя в ЕС (EC REP), который будет представлять их в регуляторных органах ЕС. Хотя эту роль может выполнять дистрибьютор, наличие независимого Авторизованного Представителя несет в себе большие преимущества, поскольку позволяет менять дистрибьюторов в любое удобное для вас время. Наше германское представительство готово взять на себя роль Авторизованного Представителя для вашей компании.
Аудиты на соответствие требованиям Регламента ЕС 2017/745 и ISO 13485
Производители медицинских изделий классов IIa, IIb и III, а также стерильных продуктов класса I или изделий класса I, предназначенных для измерений, должны ежегодно проходить аудит Нотифицированной Организации. Мы поможем вам подготовиться к аудиту. Помимо этого мы можем провести для ваших работников тренинги по процедурам получения CE-марки, Регламенту ЕС 2017/745, а также внутреннему аудиту.
Взаимодействие с Нотифицированной Организацией
Производители медицинских изделий классов IIa, IIb и III, а также стерильных продуктов класса I или изделий класса I, предназначенных для измерений, взаимодействуют с регуляторными оранами ЕС через Нотифицированные Организации. За поиск и выбор Нотифицированной организации, а также коммуникацию с ней отвечает сам производитель. Мы имеем большой опыт работы с Нотифицированными Организациями из разных стран ЕС и готовы помочь вам выбрать подходящую организацию и наладить взаимодействие с ней.
Оценка и квалификация дистрибьюторов
Согласно Регламенту ЕС дистрибьюторы изделий медицинского назначения в ЕС должны отвечать целому ряду регуляторных требований. Далеко не каждая компания, готовая продавать вашу продукцию, может стать вашим дистрибьютором. В настоящий момент в Европейском Союзе — 27 стран и более 20 официальных языков. Оценка и квалификация дистрибьюторов в таких условиях — непростая задача. Мы поможем вам найти, проанализировать и отобрать подходящих дистрибьюторов.
Получение UDI и регистрация в системе EUDAMED
*Продукция классов IIb и III с большой вероятностью потребует большого количества клинических данных. В ряде случаев могут использоваться существующие научные данные, но нередко требуется проведение клинических исследований. Клинические исследования, проводимые в ЕС должны быть одобрены Европейскими регуляторными агентствами. Планы и отчеты по клиническим испытаниям помещаются в соответствующий раздел технической документации.
**Нотифицированная Организация — организация, аккредитованная Европейским Союзом на контроль над производителями продукции медицинского назначения.
***CE-Сертификат не выдается продуктам класса I (нестерильным, без функции измерения), поскольку для медицинских изделий данного класса соответствие требованиям Регламента ЕС 2017/745 заявляется производителем в порядке самодекларации.
MDRC помогает производителям изделий медицинского назначения достичь соответствия регуляторным требованиям Европейского Союза, зарегистрировать и вывести на европейский рынок их продукцию.
Классификация изделий медицинского назначения
В ЕС определение класса изделий медицинского назначения осуществляется на основе ряда правил, изложенных в приложении VIII Регламента ЕС 2017/745. Поэтому медицинский продукт определенного класса по классификации РФ, США, Китая или другой страны, не входящей в Европейский Союз, в ЕС может относиться к другому классу продукции. Правильное определение класса вашей продукции является критически важным, поскольку от класса будет зависеть то, каким образом будет осуществляться регистрация и вывод на рынок ваших продуктов. Мы поможем вам правильно классифицировать вашу продукцию.
Обучение: CE-маркировка и регуляторная система ЕС для медицинских изделий
Технические файлы и досье разработки
Наличие технического файла является обязательным требованием ЕС, независимо от класса и типа продукта. Досье разработки обязательны для продуктов класса III. Досье разработки отличаются от технических файлов рядом дополнительных требований — в частности необходимостью обширной клинической программы. Мы создали многочисленные технические файлы и досье разработки для целого ряда различных продуктов и готовы помочь вам в создании технической и клинической документации для вашей продукции. Кроме того, мы проводим клиническую оценку продукции, разрабатываем инструкции по применению изделий медицинского назначения и помогаем добиться соответствия ISO 14971.
ISO 13485 и система менеджмента качества (СМК)
У MDRC имеются готовые процедуры и шаблоны документов, которые соответствуют регуляторным требованиям большинства стран и которые могут быть имплементированы в любой компании. Большинство компаний предпочитают использовать стандарт ISO 13485. Мы готовы помочь вам с внедрением СМК. Если у вас уже имеется СМК, мы поможем вам добиться ее соответствия европейским требованиям.
Авторизованное представительство в ЕС (EC REP)
Компании, находящиеся вне Европейского Союза, должны назначить Авторизованного Представителя в ЕС (EC REP), который будет представлять их в регуляторных органах ЕС. Хотя эту роль может выполнять дистрибьютор, наличие независимого Авторизованного Представителя несет в себе большие преимущества, поскольку позволяет менять дистрибьюторов в любое удобное для вас время. Наше германское представительство готово взять на себя роль Авторизованного Представителя для вашей компании.
MDR (EU 2017/745) и IVDR (EU 2017/746) требуют наличия у производителя медицинских изделий PRRC (Person Responsible for Regulatory Compliance).
Аудиты на соответствие требованиям Регламента ЕС 2017/745 и ISO 13485
Производители медицинских изделий классов IIa, IIb и III, а также стерильных продуктов класса I или изделий класса I, предназначенных для измерений, должны ежегодно проходить аудит Нотифицированной Организации. Мы поможем вам подготовиться к аудиту. Помимо этого мы можем провести для ваших работников тренинги по процедурам получения CE-марки, Регламенту ЕС 2017/745, а также внутреннему аудиту.
Взаимодействие с Нотифицированной Организацией
Производители медицинских изделий классов IIa, IIb и III, а также стерильных продуктов класса I или изделий класса I, предназначенных для измерений, взаимодействуют с регуляторными оранами ЕС через Нотифицированные Организации. За поиск и выбор Нотифицированной организации, а также коммуникацию с ней отвечает сам производитель. Мы имеем большой опыт работы с Нотифицированными Организациями из разных стран ЕС и готовы помочь вам выбрать подходящую организацию и наладить взаимодействие с ней.
Оценка и квалификация дистрибьюторов
Согласно Регламенту ЕС дистрибьюторы изделий медицинского назначения в ЕС должны отвечать целому ряду регуляторных требований. Далеко не каждая компания, готовая продавать вашу продукцию, может стать вашим дистрибьютором. В настоящий момент в Европейском Союзе — 27 стран и более 20 официальных языков. Оценка и квалификация дистрибьюторов в таких условиях — непростая задача. Мы поможем вам найти, проанализировать и отобрать подходящих дистрибьюторов.
Европейский сертификат соответствия СЕ: как получить, что означает CE маркировка
Что такое маркировка СЕ и какие преимущества вы получаете при ее наличии? Можно ли подделать знак и как отличить фальшивку от оригинала? Как проходит сертификация СЕ в России? На эти вопросы ответят эксперты компании «ЛенТехСертификация».
Мы расскажем обо всех нюансах процедуры, чтобы вы могли осознанно подходить к вопросу и чувствовать себя увереннее при общении с любыми специалистами.
Особенности сертификации СЕ
Что такое маркировка CE?
CE — это французская аббревиатура Conformité Européenne, что в переводе значит «Европейское соответствие».
Сертификат EC — это документ, подтверждающий соответствие товара всем нормам Европейского Союза. Кроме того, у страны, куда импортируется товар, могут быть свои требования к качеству — в этом случае приходится соблюдать и их.
Наличие подобного разрешительного документа дает право беспрепятственно ввозить продукцию в страны Европейского Союза, а также наносить на упаковку специальный знак — СЕ.
Данная маркировка подтверждает, что соответствие всем требованиям Европейского союза проверено реальными испытаниями. Европейский сертификат в обязательном порядке нужно получать, если вы хотите выходить на рынок стран ЕС, но и в России имеет смысл озаботиться этой документацией.
Кроме того, продукцию с маркировкой ЕС разрешено реализовывать в Японии, Канаде, США, Швейцарии, Австралии, Новой Зеландии и Израиле.
Маркировка CE знакома многим потребителям и выгодно выделяет товар среди прочих конкурентов. Что уж и говорить об участии в тендерах, где каждый дополнительный документ добавляет вам шансов на победу!
Какие возможности дает сертификат CE?
Подытожим кратко и понятно. Европейский сертификат на продукцию позволяет:
- Организовать экспорт в любую страну ЕС. Без этого документа вы не имеете права ввозить и реализовывать товары на территории стран Евросоюза.
- Повысить доверие покупателей. Маркировка CE сегодня — не пустой звук! Потребители стали более осознанно подходить к выбору продукции и обращать внимание на документы, подтверждающие качество и безопасность товаров.
- Обрести лояльность финансовых организаций. Банки охотнее сотрудничают с производителями, которые готовы подтверждать качество и безопасность своей продукции, показывая тем самым серьезность предприятия.
- Получить преимущество в тендерах. Вы сможете выгодно выделиться на фоне других участников и обратить на себя внимание потенциального заказчика.
Правовые основы
Правила сертификации CE в странах Европейского союза реализуются в соответствии с Решением № 768/2008/EC парламента, принятым 9 июля 2008 года. Сертификация регулируется директивами и гармонизированными стандартами ЕС.
Требования в целом сводятся к тому, чтобы идентифицировать возможные риски, связанные с использованием продукции. При этом производитель волен выбирать сам методы их устранения, с точки зрения директив важен именно результат.
Следование гармонизированным стандартам является как раз одним из способов выполнения требований, но производителю необходимо техническое подтверждение. Проще говоря, вы можете выбрать один из подходящих стандартов и тем самым подтвердить соответствие требованиям, но в таком случае обязаны доказать, что выполнение регламента действительно приведет к устранению рисков.
Процедура подтверждения безопасности бывает обязательной и добровольной, это зависит от категории производимого товара:
Обязательная сертификация требует соответствия нормам ЕС и действующим директивам государства, в котором ведется коммерческая деятельность. Касается детских товаров, пищевой продукции, средств гигиены и т. д.
Добровольную сертификацию можно оформить на любой товар, в том числе и на тот, который уже имеет обязательный сертификат. Подразумевает желание производителя документально подтвердить какие-либо характеристики товара, тем самым выгодно отстроившись от конкурентов. Сюда входят стандарты ISO, BRC, IFC, FSC и другие.
Требования к маркировке
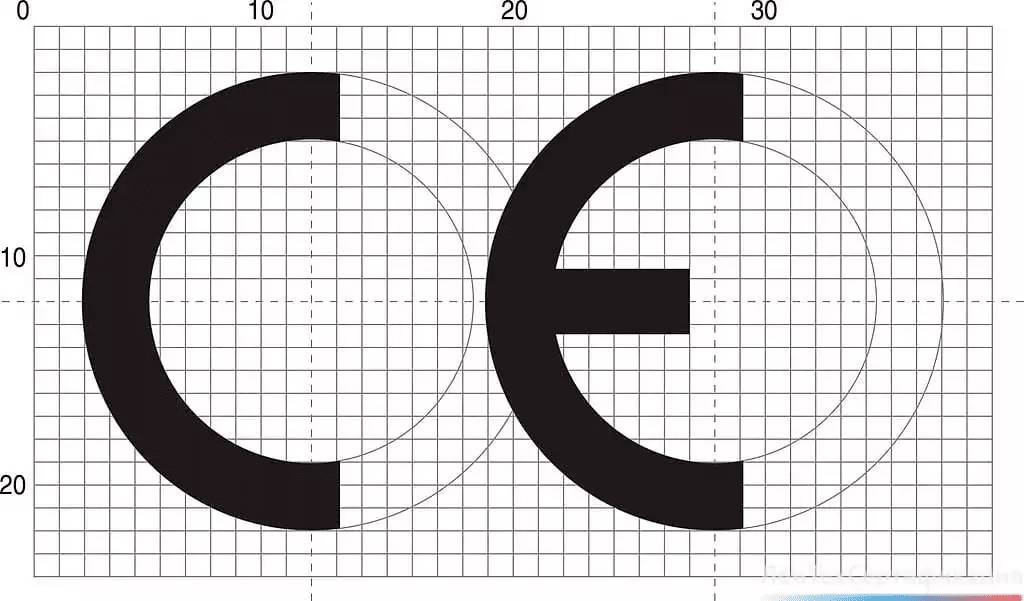
Существует несколько основных правил нанесения знака CE:
- изображение должно быть хорошо различимым и несмываемым;
- маркировка наносится до выхода продукции на рынок;
- необходим идентификационный номер нотифицированного органа;
- знак должен состоять из двух заглавных букв CE;
- размер маркировки не может превышать 5 мм в высоту;
- знак может наноситься на сам товар, его упаковку и инструкцию по эксплуатации;
- важно выдержать заданные пропорции (см. рисунок ниже);
- идентификационный номер наносится соответствующим органом или по его указанию изготовителем или полномочным представителем.
Продукция, подлежащая CE маркировке
Знаки соответствия обязательно должны присутствовать на следующих товарах:
- игрушки и прочая продукция для детей;
- медицинские устройства и техника;
- строительные товары;
- механизмы и машины;
- средства индивидуальной защиты;
- приборы радиосвязи, телекоммуникационное терминальное оборудование;
- подъемники и лифты;
- газорасходные установки и др.
Список продукции с обязательной маркировкой достаточно велик, поэтому проще и надежнее проконсультироваться со специалистом центра сертификации, чем искать ответ самостоятельно.
Кроме того, существует простая формула изделия, состоящего из комплектующих. Согласно ей, отдельные детали, имеющие маркировку СЕ, вовсе не гарантируют, что конечный продукт также будет законно помечен той же маркировкой.
Иными словами, СЕ+СЕ≠СЕ
Готовое изделие следует сертифицировать отдельно.
Срок действия сертификата
Этот параметр зависит от выбранной европейской директивы. Чаще всего речь идет о сроке в 3 года с ежегодной инспекцией, но есть и сертификаты, которые оформляются на 10 лет, и даже бессрочные. Инспекционный контроль также не регламентирован общими правилами, он может быть приглашен только при внесении каких-либо изменений в продукцию.
Как отличить подделку?
Поддельными знаками может считаться любая маркировка, нанесенная без полного соблюдения правил и без наличия подтверждающего документа. Но есть и еще один интересный момент — в Китае ставят маркировку China Export, которая очень похожа на европейский знак, незнающий человек может легко их перепутать. Но если поставить изображения рядом, то можно заметить, что буквы в китайском варианте стоят ближе друг к другу.
Сертификация CE в России
Пройти сертификацию можно по выбранной схеме. Всего существует 10 вариантов:
- Схема 1 и 1а. Вторая дополняет первую и предполагает проведение анализа состояния производства.
- Схема 2. Для импортной продукции, включает испытание образца товара в аккредитованной лаборатории. В качестве дополнения применяется схема 2а, при которой проверяется состояние производства.
- Схема 3. Применяется при оформлении сертификата соответствия на производителя. Подходит для продукции, выпускаемой на длительный срок. Подразумевает испытания отобранных образцов в аккредитованной лаборатории и инспекционный контроль на протяжении действия сертификата.
- Схема 4. Означает инспекционный контроль на производстве.
- Схема 5. Состоит из испытаний образцов продукции в аккредитованной лаборатории, сертификации производства или системы качества и контроля производства.
- Схема 6. Выбирается для контроля уже имеющейся сертифицированной системы качества. В этом случае рассматривается заявка-декларация о соответствии с прилагаемыми документами.
- Схема 7. Это контроль продукции, ввозимой в страну. В документе прописывается точное число единиц товара и контракт на поставку. При этом срок действия сертификата неограничен.
- Схема 8. Выбирается для разовых партий, причем испытания в аккредитованной лаборатории проходят над каждым образцом.
- Схема 9. Для небольшой партии или единичного экземпляра. Проводится рассмотрение заявки-декларации о соответствии с прилагаемыми документами без испытаний в аккредитованной лаборатории и инспекционного контроля.
- Схема 10. Это подтверждение соответствия продукции, выпускаемой ограниченными партиями, но на протяжении длительного времени. На протяжении действия разрешительного документа аккредитованный орган осуществляет инспекционный контроль у изготовителя и продавца.
Процедура сертификации проводится в несколько общих этапов:
- Определение директивы, по которой будет производиться проверка соответствия.
- Аудит предоставляемой заявителем документации.
- Проведение лабораторных испытаний.
- Итоговая проверка отчетов и протоколов уполномоченным экспертом.
- Оформление и выдача сертификата.
Как получить желанный документ?
Вы можете оформить СЕ сертификат самостоятельно или обратиться в центр сертификации. В первом случае вы сэкономите деньги, однако все заботы по сбору документации, выбору лаборатории и получению договоренностей лягут на вас, что может привести к большим временным затратам и многочисленным правкам. Специалисты по сертификации заранее знают, как правильно собрать пакет документов, оформить заявку, что потребуется для проведения испытаний, а также многие другие нюансы, которые помогут пройти сертификацию в разы быстрее.
Стоимость услуги
Чтобы рассчитать точную стоимость сертификата СЕ, необходимо обратиться к сотрудникам центра сертификации и сообщить, на какую именно продукцию вы хотите получить документ. Наши менеджеры помогут разобраться со всеми подводными камнями на бесплатной консультации. Просто позвоните нам или оставьте сообщение в окне обратной связи. За годы работы сотрудники «ЛенТехСертификации» помогли сотням компаний начать деятельность в правовом поле и выгодно выделиться в конкурентной среде. Обращайтесь!
Ec rep что означает маркировка
Определение Директив ЕС, требованиям которых должна соответствовать продукция:
93/42/ЕЭС – для медицинских изделий (MDD) or 90/385/ЕЭС — для активных имплантируемых медицинских изделий (AIMDD).
Определение классификации продукции с помощью приложения IX Директиву для медицинских изделий (MDD):
Класс I (нестерильные, без фунции измерения),Класс I (стерильные, с фунцией измерения),Класс IIa,Класс IIb или Класс III/AIMD*.
* Активные имплантируемые медицинские изделия подлежат тем же нормативными требованиями как изделия Класса III
Для всех устройств, кроме Класса I (нестерильные, без функции измерения), осуществить Систему Менеджмента Качества (СМК),
в соответствии с Приложением II или Приложением V директивы MDD.
Для продуктов Класса III/AIMD, подготовить Дизайн Досье (Design Dossier*).
Для всех остальных устройств, подготовить ЕС Технический файл, который содержит подробную информацию подтверждающую соответствие медицинского изделия
директиве MDD 93/42/ЕЭС.
* Для устройств Класса III / AIMD будут необходимыми данные клинического исследования. Клинические испытания в Европе должны быть предварительно одобрены европейским нотифицированным органом.
Назначить Европейского Авторизованного Представителя (EC REP), который расположенный в Европе.
Поместить название и адрес ЕС REP в инструкции по применению и на упаковке.
Авторизованный
Представителт
Для всех устройств, кроме Класса I (нестерильные, без функции измерения),
Ваша СМК и Технический Файл или Дизайн Досье должны пройти проверку Нотифицированным Органом, который является третьей стороной, аккредитованной Европейскими властями для оценки медицинских изделий и компаний — производящих продукты медицинского назначения.
Подготовка Декларации Соответствия, которая является документом имеющим обязательную юридическую силу, подготовленным изготовителем с указанием,
что устройство соотвечает приенимым Директивам.
Для всех медицинских изделий и средств IVD в Европейском Союзе, сертификат CE является необходим. Эта сертификация подтверждает, что устройство соответствует всем нормативным требованиям «Медицинских Директив».
Ec rep что означает маркировка
1.Введение
Маркировка медицинских изделий должна играть важную роль при проектировании, разработке, производстве и остальных этапах жизненного цикла медицинских изделий, в том числе при эксплуатации. К сожалению, практика показывает, что производители либо не уделяют ей и её описанию должного внимания, либо весьма ловко и искусно скрывают свои усилия по этим направлениям. Например, почему в руководстве по эксплуатации нет или очень мало информации о маркировке, её содержании, расположении? Или почему при изучении стадий проектирования или производства медицинского изделия того или иного производителя достаточно часто нет информации о маркировке изделия? Или при изучении файла менеджмента риска медицинского изделия –часто из файла удается только понять, что маркировка на изделии есть, а речи об опасностях и рисках того или иного рода, связанного с маркировкой медицинского изделия, её эксплуатационной пригодностью и «читаемости» ничего не указано?
Конечно же, приведенное выше мнение может показаться чрезмерно пессимистичным. Попробуем разобраться, для чего нужна маркировка, какую информацию о ней требуется или желательно указывать. Причем начнем не с «тяжелой артиллерии» — требований, постановлений, стандартов, а с «конца» — то есть с того, что обычный пользователь изделия, не обязательно медицинского, привык видеть каждый день на маркировках и сопроводительной документации.
2.Идентификация изделий
Можно предположить, что обычный пользователь ничего не знает о требованиях к маркировкам, их содержанию, что их регламентирует, как нужно их описывать. Это в большинстве случаев верно – но в то же время он может наблюдать их повседневной жизни по много раз в день, и таким образом у него складывается свое собственное мнение, что же там должно быть указано. И «поймав» обычного пользователя с предложением пройти опрос, что должно быть на маркировках тех или иных продуктов, можно оказаться достаточно сильно удивленным, когда оный пользователь перескажет Вам чуть ли не большую часть требований стандартов или регламентов, не имея вообще никаких знаний, кроме тех, что такие требования в наше время где-то должны быть описаны. Но эти знания он «приобрел», так как он видел одну и ту же информацию, вернее, один и тот же набор приводимой информации плюс-минус, много тысяч раз.
Можно достаточно долго развивать эту мысль, приводить примеры того, что «клиентоориентированность», «эксплуатационная пригодность» и прочие явные и не явные параметры и свойства важны. Причем весьма вероятен и такой результат изучения определенного продукта пользователем – «у этого производителя это указано / написано / предусмотрено, а у этого – нет, значит первый лучше при прочих равных», то есть можно поговорить и о конкурентной способности изделий. Но вернемся все же к конкретике — информации на маркировках. Приведем ниже предположительное описание информации, полученной от «обычного пользователя» о том, что должно быть на маркировках, с некоторыми комментариями и примерами.
Итак, что же обычный пользователь привык видеть в первую очередь на маркировках изделий? Это наименование продукта – то есть верная и корректная идентификация изделия, скажем так, это аналог ФИО в паспорте в общем смысле этого слова. Иначе, это ответ на вопрос «что находится перед нами?».
Далее — во всех ли случаях указания наименования будет достаточно? Или, скорее, что должно включать в себя наименование? Предположим, что производитель делает несколько моделей под одним наименованием – получается, что наименование должно включать в себя и уточнения, если такие имеются. Большинство производителей, конечно же, так и делает – указывает наименование и модель. Или указывает наименование и номер по каталогу – REF номер (или его аналог). Или все три параметра. Но тут вернемся к предыдущему абзацу и примеру из него – «ФИО в паспорте». Можно было обратить внимание, что это не очень удачный пример – так как в может быть много человек с одним и тем же ФИО в одной стране. И тут-то как раз уже можно выводить достаточно много производителей на «чистую воду» — словосочетание «верная и корректная идентификация изделия» несет в себе смыслы и «полная», и «окончательная» идентификация. Приведем несколько примеров – производитель выпускает свои изделия в разных цветах / разных оформлениях, цвет (оформление) не указан ни в модели, ни в номере по каталогу, ни где-либо еще. Производитель подумает – а зачем? Не будем предполагать, что подумает пользователь о производителе, если он стоит на складе перед двумя одинаковыми коробками без возможности определить, какая коробка содержит изделие нужного ему цвета (оформления).
Можно сказать, что цвет не имеет влияния на функциональные характеристики – не будем заострять внимание на изделиях для детей или для взрослых. Приведем другой пример – производитель поставляет под видом одной модели изделия с разным внутренним устройством – то есть с разными функциональными характеристиками и, более того, более широким-узким назначением. Здесь уже пользователь не во всех случаях по внешнему виду, как для цвета (оформления), сможет понять, какая модификация где. И это очень печально.
Таким образом, подведем итог рассуждениям по поводу наименования, оно же – «верная и корректная идентификация». Пользователь при изучении «полного наименования» изделия, в том числе на маркировке, которое может включать: наименование изделия, модель и номер по каталогу или их аналоги, доп. параметры – не должен задумываться «а правильно ли я все понял», искать какие-либо отличительные признаки, присутствующие на одной модели, но отсутствующие на другой и так далее – информация для идентификации должна быть достаточной и исчерпывающей. Особенно это важно при ситуациях, требующих «экстренных» мер – любая ошибка или задержка в таких случаях может привести к нанесению вреда или чему-либо похуже.
Теперь расширим наш термин «идентификации» другими параметрами — это информация о производителе изделия, его адресе и контактных данных, например, телефоне, адресе электронной почты, сайте – по отдельности и вместе. По сути, это не только вопрос идентификации изделия, так как вполне возможен, пусть даже и с небольшим шансом, случай, когда изделия будут названы полностью одинаково (или производители будут названы одинаково, но располагаться в разных странах), но и указание информации о главном «ответственном» за данное изделие лице. Также для пользователя этот параметр важен, так как чем более известен производитель, там больше доверия он вызывает при прочих равных, тем более качественным считается изделие. Статистически, здесь проблем не бывает – производитель всегда указывает информацию о себе. Проблемы возникают в другом – в актуальности этой информации при изменении её частей – наименовании производителя, его организационно-правовой формы, адреса и т.д. Мы не заостряли внимание на этом раньше – но любая информация, сопровождающая изделие, в том числе на маркировке, должна быть актуальной. И её обновление должно происходить максимально быстро.
Дополнительный параметр, который вытекает из указания информации о производителе – это место производства изделия. Если у производителя несколько производственных площадок или адрес расположения производственной площадки отличается от места расположения офиса производителя, то следует указать и эту информацию, опять же, утрированно, в рамках идентификации и вопроса «кто виноват и где его искать?». Для пользователя этот параметр важен, опять же, по вопросам доверия – чем более «надежной» считается страна расположения производственной площадки, тем большое доверие получает изделие.
Вполне резонно заметить, что если производитель находится за рубежом, то ему необходимо иметь некоторое региональное представительство, как минимум, по законодательным причинам и наличию языковых барьеров, и указывать на маркировке информацию об его Уполномоченном представителе на некоторой территории (некоторой стране, группе стран). Примером данного требования является хорошо известный «EC REP» — Уполномоченный представитель в Европейском сообществе, символ и информацию о котором с 100% вероятностью можно увидеть на маркировках медицинских изделий в ЕС (если он сам не располагается на территории ЕС или его обязанности делегированы).
Укажем ещё один очевидный параметр, который требуется не забыть привести на маркировке – серийный номер или номер партии. Он указывается для идентификации или отслеживания конкретного экземпляра или конкретной партии изделий. Например, для определения, какой конкретно экземпляр изделия требуется отправить на плановое обслуживание, если их несколько на балансе. Или в серийном номере или номере партии достаточно редко, но иногда может кодироваться информация о производственной площадке или дате производства, или модели, или проч. Не забудем и про даты – вот, на что именно пользователь обращает внимание в одну из первых очередей на маркировке и упаковке изделия – дата производства, и, если применимо – дата истечения срока годности (или аналоги) – о них подробней поговорим чуть позже.
Рассмотрим частный случай – изделие представляет собой многоэлементное – чаще в случаях многоразового изделия. Тогда очень важно не забыть промаркировать каждый (при возможности) элемент изделия, и на маркировке элемента указать, как именно он называется. Иначе применение изделия будет затруднено, так как пользователю в общем случае может потребоваться больше времени на изучение, что это за элемент, как его применять, куда его присоединять и т.д.
И еще один частный случай, который скорее относится к дополнительной идентификации производителя, линейки продуктов или конкретного изделия – это товарные знаки. На маркировках часто располагают зарегистрированные соответствующим образом и находящиеся под охраной на определенной территории товарные знаки. Пользователь очень часто наблюдает их на маркировке или упаковке. И, опять же, бренд или товарных знак может вызывать у него разный уровень доверия к изделию. Но достаточно небольшому количеству пользователей будет понятно, почему мы привели именно такую формулировку ранее — «зарегистрированные соответствующим образом и находящиеся под охраной на определенной территории…». Очень часто случается, что производитель забывает, что товарный знак должен быть защищен на территории страны применения его изделия, иначе требуется убрать знаки охраны товарных знаков, информацию о защите товарного знака и проч.
Просуммируем вышеприведенное про информацию на маркировке изделия в рамках идентификации и что на ней требуется обычно указывать:
- Наименование изделия – обязательно для идентификации.
- Модель, номер по каталогу и проч. — обязательно (при наличии) для идентификации.
- Информация о производителе – обязательно для идентификации.
- Производственная площадка – обязательно (при наличии) для идентификации.
- Информация об уполномоченном представителе – обязательно или рекомендуется для идентификации лица, ответственного по определенным активностям на определенной территории обращения изделия.
- Серийный номер или номер партии, даты – обязательно для идентификации.
- Наименование элемента изделия – обязательно для идентификации элемента многоэлементных и, как правило, многоразовых изделий.
- Товарный знак – по желанию при наличии надлежащей регистрации в стране применения.
3.Применение изделия
Перейдем к вопросу – «что обычно располагается на маркировке изделия в целях его надлежащего применения?».
Начнем с того, что на большинстве маркировок располагается указание на применение в соответствии с сопроводительной документацией – то есть на руководство по эксплуатации (инструкцию по применению, руководство пользователя и проч.). Это делается для того, чтобы напомнить пользователю, что изделие допускается применять в соответствии с содержанием сопроводительной документации, и ознакомление с ней перед использованием – обязательно абсолютно для всех изделий (изучение сопроводительной документации и / или описания на упаковке / изделии), и никак иначе. Шутки типа: «инструкцию читают только тогда, когда нечего читать, или уже все безнадежно сломано» — крайне несмешные, особенно для изделий повышенного риска для здоровья, таких, как медицинские изделия. Приводите пользователю требование об обязательном изучении сопроводительной документации везде, где только можно и разумно – пользователь крайне не любит читать инструкции от слова совсем.
Далее, на маркировке изделий также располагают важные запретительные / разрешительные знаки – содержит тот или иной материал – для пользователей с аллергией, использовать повторно нельзя, использовать можно только в помещении, использовать совместно только с таким изделием т.д.
Здесь необходимо заострить внимание на одной проблеме, которая встречается пугающе часто – отсутствие должного описания маркировки и её содержания, расположения. Пользователь, например, может сказать, в некоторых случаях весьма резонно, – «я вижу символ, но не вижу его описания — как я могу понять, что он означает?». Любая ситуация, которая может вызвать вопросы у пользователя – это удар по безопасности и эффективности изделия. Это шанс на возникновение ненадлежащего применения изделия. Практически никогда нет явных причин не указывать описание содержания маркировки.
Еще одним важным параметром, который указывают на маркировке – это даты и временные промежутки – даты изготовления, срок годности, дата окончания срока годности и проч. в различных комбинациях. Для определенных изделий (чаще многоразовых) – это в основном дата изготовления. Для других типов изделий, когда критически важно привести срок годности изделия именно на маркировке (одноразовые стерильные, например), основной акцент приходится на дату окончания срока годности – после её наступления строго запрещено применение изделия. Вариантов указания дат и сроков на маркировке много – только дата изготовления (если в сопроводительной документации указан срок эксплуатации), или дата изготовления и дата окончания срока годности, или дата изготовления и срок годности и др. Главное – точная и простая идентификация даты изготовления и даты окончания возможного применения медицинского изделия.
Также немаловажными параметрами, которые требуются указать на маркировке – это характеристики изделия – их набор зависит от конкретного типа изделия. Например, это могут быть размеры рабочей части – их указывают не «для галочки», а чтобы дать возможность пользователю быстро разобраться, подходит ли данное изделие для применения в конкретном случае. Или электрические параметры – самое простое объяснения их наличия: можно или нельзя подключить в данном месте к сети питания.
Перейдем к очень важному вопросу, который задается производителями очень часто, но вызывает искреннее недоумение – «нужно ли приводить маркировки (и сопроводительную документацию) на языках места обращения изделия?». Обычного пользователя такой вопрос, скорее всего, также сильно удивит. Он спросит: «а как мне применять изделие, если я знаю только родной язык?». Как можно говорить о безопасности и эффективности применения изделия, если пользователь не понимает, что написано на маркировке? Более того, предположим, что мы спросим профессора-лингвиста в каком-нибудь университете: «Скажите, пожалуйста, как Вы думаете, Вы лучше понимаете язык, который изучаете почти всю свою жизнь, по сравнению с обычным носителем языка?». Скорее всего, уважающий себя профессор ответит, что он был бы не столь уверен, что «осилит» «носителя языка» в этом вопросе – то есть подтверждения «полного понимания» написанного на иностранном языке у пользователя, пусть даже и с некоторым приличным уровнем «владения языком», нет. Из чего можно сделать вывод – есть ли требования к указанию маркировок и их содержанию или нет на родном языке в области обращения – не важно, их нужно указывать на языке области обращения (или приводить мультиязычную / несколько моноязычных маркировок).
4.Выводы
Подведем итог наших размышлений – что должно быть приведено и как должно быть приведено на маркировке.
Маркировка должна или может содержать:
- Наименование изделия
- Модель, номер по каталогу и проч.
- Информация о производителе.
- Производственная площадка.
- Информация об уполномоченном представителе.
- Серийный номер или номер партии
- Даты изготовления или даты изготовления и срок окончания применения.
- Наименование элемента изделия.
- Товарный знак.
- Ссылку на «использовать в соответствии с сопроводительной документацией».
- Разрешающие или запрещающие знаки по надлежащему применению изделия.
- Соответствующие данному типу изделий параметры и характеристики.
И, что очень важно, содержать информацию на языке области обращения изделия.
Choosing an EU Authorised Representative (EC REP) for Medical Device Regulatory Issues
So you’re ready to export to Europe. You’ve tackled the myriad tasks associated with packaging, marketing, shipping, and distributing your medical devices. But wait, a host of regulatory issues still loom.
One such issue that confronts all non-European manufacturers that sell devices in Europe is the appointment of an Authorised Representative . In their zeal to get products out the door, most people don’t give it much thought, but there are good reasons why you should.
What is an Authorised Representative (EC REP)?
Essentially, an EC REP plays an intrinsic part in post-market surveillance, including vigilance. The Authorised Representative (AR) is your link to European authorities, and they must maintain physical presence in Europe. They will register your medical device or IVD before it is marketed, and will always be available to serve as a contact between you and the Competent Authorities of the EU member states.
Your AR will also have access to your Technical File(s), which must be available for inspection by the Competent Authorities. In other words, a variety of the responsibilities of the manufacturer are delegated to the Authorised Representative. The name and address of your AR must be placed on the information that accompanies your device, such as (packaging) labeling and instructions for use.
In the event of an incident, your AR will assist and coordinate the reporting of the incident to the Competent Authorities, and will cooperate with you and your distributors to ensure that the proper reporting and follow up protocols are followed. In the event that your device is withdrawn from the market, your medical device Authorised Representative can represent you to the European Commission for consultation.
These are the tasks that you delegate to your representative to perform on your behalf. However, it is important to note that the EC REP is not legally responsible for non-conforming devices, unless the problem is a direct result of one of these tasks.
The manufacturer should always responsible for the safety of the device. Some of the Member States’ Competent Authorities however are of the opinion that the Authorised Representative can be held responsible for the device. This opinion provides a challenge for the Authorised Representative which has no control over design, manufacture, packaging and labeling of a device, otherwise the AR would be a manufacturer.
Choosing an European Authorised Representative
Make sure you know exactly what the role is of the AR and which of the responsibilities you need to delegate. At minimum, an AR must be able to handle (near) incident reporting, product recalls, complaint handling, and post-market feedback.
Each AR provides slightly different services, although many will custom tailor a contract for you, and obviously fees will vary. Determine which EC REP services you need, and how much you are willing to pay, and choose an EC REP who most effectively (and efficiently) can meet those needs.
Regardless of your product, you should look for an AR who has considerable European regulatory experience with medical devices or IVDs. European regulations and vigilance can be complicated, and your AR should have experience with a wide range of devices. When talking to different AR providers, your Authorised Representative need not always have to have the expert knowledge of your device and technology, but they should be able to guide you through the regulations and requirements that apply to your device.
Considering the role of the AR, it is important to ensure that the responsibilities of both you, as the manufacturer, and your selected AR are clearly outlined and stipulated in a contract.
Using a distributor as your Authorised Representative in Europe
Some companies opt to use their distributor or importer as their Authorised Representative. Many distributors, however, may not be aware of the role and responsibilities of Authorised Representation. There are other issues to consider.
Your distributor’s name and address will be on all of your materials, no matter where they are sold in Europe. If you decide to change distributors, you will have to reprint all of your labels, manuals, packaging, and are presented with a potential challenge on how to deal with the products on the market that have that distributor’s name on them. Besides, if you choose one distributor among several to be your Authorised Representative, such an arrangement may create ill will among your other distributors.
A distributor should focus on the sale and marketing of your devices, not on regulatory affairs. If the European laws and guidelines are modified, are you sure your distributor will keep abreast of these changes and notify you when changes affect your devices? In the regulatory affairs world, ignorance is not bliss.
Your distributor, as your Authorised Representative, will have access to your Technical File(s), which may include proprietary information. A related issue deals with recall and (near) incident reporting. If the Competent Authorities question an incident or a noncompliance that occurred with your product, can you be sure your distributor will defend your company. or protect their own interests? That being said, companies that sell Class I devices who only intend to sell in a few countries through a single distributor might try to save some money appointing the distributor as their AR. However, since the annual cost of appointing an AR is generally under US$3,500, you may want to weigh the risks versus benefits of such a decision.
Regardless of whether you decide to choose a distributor or an independent party as your AR, you should select someone who has some history in the business. If the company you select is only a few years old, they may end up going out of business.
In that case, guess who pays the bill for reprinting Instructions for Use, labels and packaging? Furthermore, a company with more history and experience in the business may have stronger personal relationships with Competent Authorities, which may work to your advantage if problems arise.
Increased scrutiny from European authorities
European officials will continue to tighten regulations regarding vigilance. Remember that the manufacturer must ensure that their devices conform to applicable standards and directives — neither your AR nor a distributor can guarantee this for you.
Therefore, it is important to choose an Authorised Representative who has strong connections in Europe, who stays on top of changes in regulatory affairs, and who makes serving your representation needs their first priority.
Monitoring and complying with European regulations can be challenging. Choosing an Authorised Representative for your medical device or IVD company is a serious decision, one which will affect you for years. Careful consideration of the points outlined above — your needs, their experience, the company’s history, and the question of appointing a distributor — will help you make the best decision for your company.
This content was originally published by EMERGO by UL and can be viewed by clicking here.
CE сертификат медицинского изделия
Единый рынок Европейского союза является одним из самых перспективных для реализации медицинских изделий. В статье мы рассказываем как получить разрешительную документацию для свободной продажи изделий, произведённых за пределами ЕС.
Что такое CE сертификат и CE маркировка медицинского изделия
В переводе с французского сокращение CE означает «европейское соответствие» – conformité européenne. СЕ маркировка (или CE марка) ‒ символ, означающий, что медицинское изделие соответствует регуляторным требованиям Европейского Союза. Регуляторные требования изложены в европейских регламентах:
Медицинские изделия, которые не соответствуют этим требованиям, нельзя импортировать в Европейский Союз и допускать в обращение на его территории.
Соответствие регуляторным требованиям может подтверждаться:
Декларация соответствия для медицинских изделий I класса (нестерильных и не обладающих измерительной функцией) оформляется самим производителем (самодекларирование).
Для остальных изделий для легального обращения не территории ЕС необходимо оформить CE сертификат при участии нотифицированного органа Европейского Союза.
CE сертификат содержит следующие сведения:
Преимущества и актуальность CE сертификации
В последнее время процедура регистрации медицинских изделий в РФ и ЕАЭС стала значительно сложнее и дороже для производителей и импортеров. Только за последний год стоимость испытаний увеличилась в 2‒3 раза.
В то же время значительно сократилось количество лабораторий готовых провести испытания. Это связано как с ужесточением требований к самим лабораториям (со стороны Росаккредитации), так и к результатам испытаний (со стороны экспертных организаций Росздравнадзора). Все это приводит к существенному росту издержек и увеличению сроков проведения испытаний.
Одновременно с этим постоянно меняется законодательство, регулирующее обращение медицинских изделий. Так обещанный полноценный переход на правила ЕАЭС в очередной раз откладывается, при этом национальная процедура по правилам РФ временно приостановлена.
Хотя принято предварительное решение о ее продлении до конца 2022 года, окончательные сроки возобновления национальной процедуры пока не ясны.
В этой связи альтернативой получения регистрационного удостоверения в РФ или ЕАЭС может стать получение СЕ сертификата на медицинское изделие.
Это откроет для производителей и импортеров следующие преимущества:
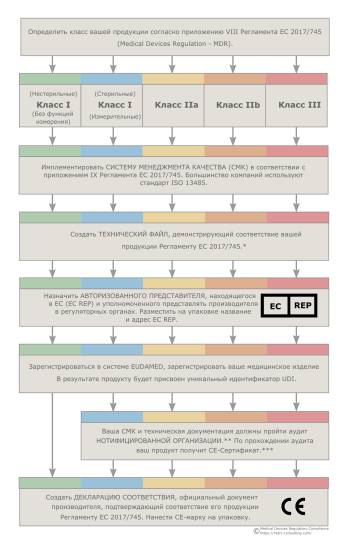
Этапы CE сертификации медицинского изделия
Процедура получения СЕ сертификата определяется следующими документами в зависимости от типа медицинского изделия:
Разберем основные этапы регистрации медицинского изделия в Европе на схеме с пояснениями.
Как видно из схемы, для медицинских изделий I класса (нестерильных и не обладающих измерительной функцией) процедура CE сертификации значительно упрощена. Она не требует участия нотифицированного органа. Поэтому процесс называется самодекларированием. Однако изделие также должно полностью соответствовать требованиям Регламента.
Производитель также обязан внедрить и поддерживать адекватную систему менеджмента качества, хранить и актуализировать технический файл, иметь уполномоченного представителя и своевременно передавать сведения в EUDAMED. Только на этих условиях производитель вправе декларировать соответствие требованиям Регламента, выпускать декларацию соответствия и наносить CE маркировку на изделие.
Степень участия нотифицированного органа в сертификации остальных изделий I класса:
Для изделий классов II и III участие нотифицированной организации в регуляторном процессе значительно возрастает при увеличении класса, поскольку увеличиваются риски.
Европейский представитель производителя медицинского изделия
В соответствии с требованиями регламентов MDR 2017/745 и IVDR 2017/746, у каждого производителя, не являющегося членом Европейского союза, если он планирует продавать свои изделия на территории ЕС, должен быть уполномоченный представитель (European Authorized Representative). Это относится ко всем изделиям вне зависимости от их класса.
Уполномоченный представитель ‒ это юридическое лицо, учрежденное в ЕС, которое получило письменное право действовать от имени производителя, который осуществляет производство изделий за пределами Европейского союза. Задачи и обязательства, которые берет на себя представитель, определяются соответствующими регламентами.
Основные функции и обязанности уполномоченного представителя в ЕС:
позволяет производителю (нерезиденту ЕС) размещать свой адрес на упаковке;
хранит декларации соответствия, сертификаты, технический файл, тестовые отчеты и другие документальные свидетельства, подтверждающие качество и безопасность медицинского изделия. Обеспечивает актуальность перечисленных документов;
Задачи, порученные производителем европейскому уполномоченному представителю, должны быть четко обозначены и закреплены в письменной форме. Нельзя поручать представителю задачи, выполнить которые может только производитель. Например, обеспечение соответствия производственного процесса документации производителя, разработку и актуализацию этой документации.
Строгость требований к уполномоченному представителю в ЕС зависит от класса риска изделий. Поскольку авторизованный представитель должен контролировать соответствие продукта, производителя и его СМК требованиям регламентов ЕС, компетентность самого представителя должна позволять ему работать с медицинскими изделиями в строгом соответствии с требованиями нормативных документов!
На маркировке медицинского изделия сведения об уполномоченном представителе в ЕС обозначаются с помощью символа EC REP (см. рисунок).
На маркировке для европейского уполномоченного представителя указываются его наименование, адрес. Дополнительно можно указать контактный телефон и адрес электронной почты.
Среди наших официальных партнеров есть организации, выступающие уполномоченным представителем в Евросоюзе для производителей медицинских изделий нерезидентов ЕС.
Что такое нотифицированный орган и его функции
Нотифицированные органы – это организации, уполномоченные Европейской комиссией проводить оценку соответствия в ЕС или третьих странах. Каждый орган должен пройти процедуру официальной аккредитации и должен подтвердить свою компетентность в той или иной области. Для оценки соответствия медицинских изделий нотифицированный орган должен продемонстрировать компетентность в отношении MDR 2017/745 и/или IVDR 2017/746 (для изделий in vitro). Перечень аккредитованных нотифицированных органов представлен на сайте Европейской Комиссии в разделе «NANDO нотифицированные органы».
Для каждого Регламента есть отдельные списки нотифицированных органов, которые могут оказывать услуги по аудиту, инспекции и сертификации. По Регламенту MDR 2017/745 на сегодня таких органов не более 30, а по IVDR 2017/746 – меньше 10 (см. рисунки).
Результаты поиска нотифицированных органов (Регламент MDR 2017/745)
Результаты поиска нотифицированных органов (Регламент IVDR 2017/746)
Сведения о нотифицированном органе, который принимал участие в оценке соответствия изделия, приводится на его упаковке и отображается под символом CE в виде четырехзначного номера (NB number).
Что такое технический файл медицинского изделия
Согласно законодательству ЕС для каждого медицинского изделия должен быть разработан технический файл (technical file). Он содержит требования при проектировании, производстве, обращении, эксплуатации и утилизации медицинского изделия. Ответственность за сведения, содержащиеся в техническом файле, возлагается как на производителя, так и на уполномоченного представителя.
Минимально технический файл должен содержать следующие разделы:
подробная информация о проектировании и производстве изделия (в виде блок-схем с пояснениями процессов и их взаимосвязей). Необходимо отразить информацию о производственном процессе, поставщиках и используемых материалах;
история изменений, вносимых в технический файл.
Напоминаем, что для изделий IIa, IIb и III классов риска, а также изделий I класса стерильных (Is), многоразовых хирургических инструментов (Ir), изделий с измерительной функцией (Im) осуществляется аудит технического файла со стороны нотифицированного органа!
На практике детальные требования к формату и составу технического файла устанавливаются конкретным нотифицированным органом.
Минимальный срок хранения документов технического файла составляет 10 лет с даты окончания производства.
Полные требования к содержанию технического файла приведены в Приложении II к EU MDR 2017/745 и в Приложении II к EU IVDR 2017/746 в отношении изделий для диагностики in vitro.
Испытания медицинских изделий для СЕ сертификации
В процессе подготовки технического файла производитель должен провести все необходимые испытания медицинского изделия. Целью их проведения является подтверждение соответствия требованиям MDR 2017/745, MDR 2017/746 и применимым к изделиям стандартам.
Условно испытания можно разделить на следующие группы:
В составе технического файла результаты испытаний приводятся в разделе верификация и валидация изделия (Product verification and validation).
Технические испытания ‒ испытания, проводимые с целью определения соответствия характеристик (свойств) изделия требованиям нормативной документации, технической и эксплуатационной документации производителя. К ним можно отнести: определение габаритов, массы, жесткости, испытания функциональные характеристик, проверку устойчивости к климатическим и механическим воздействиям, подтверждение заявленного срока годности/эксплуатации и т.д.
Испытания на биосовместимость – подтверждают безопасность применяемых при производстве медицинского изделия материалов при их контакте (прямом или опосредованном) с телом человека.
Доклинические испытания – проводятся на животных с целью получения данных об эксплуатации медицинского изделия в живом организме до применения на человеке. В силу специфики медицинских изделий далеко не все могут быть предварительно испытаны на животных.
Клинические испытания – испытания с человеком в качестве субъекта испытания. Данные испытания проводятся не всегда. Для получения CE сертификата необходимы клинические данные, подтверждающие клиническую эффективность и безопасность медицинского изделия.
Для изделий с низким классом риска такие клинические данные могут быть получены из научной литературы, клинического опыта применения эквивалентного изделия. В случае имплантируемых устройств и устройств III класса, клинические испытания с человеком в качестве субъекта являются обязательными (за исключением некоторых четко оговоренных ситуаций).
В подавляющем большинстве случаев СЕ сертификат можно получить без проведения клинических испытаний. Однако в любом случае производителю потребуется подготовить отчет о клинической оценке (Clinical evaluation report), включающий анализ всех доступных для оценки клинических данных.
К специфическим испытаниям относятся те, которые проводятся для отдельных видов изделий. В качестве примера можно привести испытания электромагнитной совместимости.
Где проводить испытания медицинского изделия
СЕ сертификация допускает, что часть испытаний производитель может провести самостоятельно на месте производства медицинского изделия. Однако при прохождении аудита СМК вопросы, связанные с проведением испытаний силами производителя, оцениваются нотифицированным органом. Как правило, производитель может подтвердить соответствие габаритных размеров, массы, иные параметры, которые подлежат выходному контролю в процессе производства. При этом все испытания должны быть проведены по методикам испытаний, признаваемым ЕС. Если применяются иные методики, их применение должно быть обосновано, а сами методики валидированы непосредственно производителем.
Испытания, которые производитель не может провести собственными силами (как правило, испытания на электромагнитную совместимость, стерильность, биосовместимость и т.д.) крайне желательно провести в лабораториях, аккредитованных в международной системе ILAC (по стандарту ISO 17025) или лабораториях, признанных национальными органами аккредитации стран ЕС. Область аккредитации таких лабораторий должна включать требуемые стандарты и методики. Результаты, полученные в таких лабораториях, принимаются нотифицированными органами без нареканий.
Доклинические испытания должны быть проведены в исследовательских центрах, соблюдающих требования стандартов и рекомендаций по проведению испытаний с использованием животных. Гуманность и отсутствие необоснованных страданий должны быть приоритетны в процессе проведения испытаний.
Клинические испытания должны быть проведены только после получения заключения этического комитета об одобрении клинических испытаний в тех медицинских учреждениях, в которых имеется опыт применения изделий аналогичных тем, которые планируется испытать.
Что такое система EUDAMED и ее функции
Eudamed ‒ это единая европейская информационная система для медицинских изделий и экономических операторов (субъектов обращения), обеспечивающих вывод и обращение медицинских изделий на рынке ЕС. Регистрация в системе Eudamed является обязательной и определяется требованиями регламентов ЕС MDR 2017/745 и ЕС IVDR 2017/746.
Система состоит из шести взаимосвязанных модулей:
В каждый из указанных модулей вводится соответствующая информация на официальном сайте EUDAMED. Эта информация является общедоступной, что повышает прозрачность рынка медицинских изделий ЕС.
Кто должен регистрироваться в EUDAMED
Регистрация в EUDAMED является обязательной для:
Важно отметить, что регистрироваться должен любой производитель, независимо от того, находится ли он в Европейском союзе или нет.
Если производитель не является резидентом ЕС, к моменту его регистрации в EUDAMED в систему должны быть внесены сведения об уполномоченном представителе производителя на территории ЕС.
В случае выполнения экономическим оператором нескольких ролей, то он должен регистрироваться в системе в каждой из них.
Для получения регистрационного номера (Single Registration Number, SRN) российскому производителю необходимо направить заявку в адрес своего уполномоченного представителя. После этого авторизованный представитель должен одобрить эту заявку.
Только после этого российский производитель получит свой SRN. Если экономический оператор регистрируется в нескольких ролях (например, производитель и уполномоченный представитель), то для каждой из них он должен получить уникальный SRN.
Сроки получения CE сертификата
Сроки зависят от следующих факторов:
Кроме того, Регламент EU MDR ввел дополнительные требования, особенно в отношении систем менеджмента качества. Это делает весь процесс более сложным и трудоемким, а, следовательно, увеличивает сроки оформления сертификата.
По нашему опыту, в среднем сроки получения СЕ сертификата при разработке документов на изделие и СМК с «нуля» следующие:
I класс – от 4 месяцев;
При наличии части необходимых документов и/или действующего сертификата СМК указанные сроки могут быть существенно сокращены.
Срок действия сертификата CE
CE сертификат обычно действует в течение 3 лет. Для медицинских изделий высокого класса риска этот срок может уменьшаться до 1 года. Максимальный срок может составлять 5 лет. Досрочно действие сертификата CE может прекращаться по результатам неудовлетворительного контрольного аудита со стороны нотифицированного органа.
Стоимость CE сертификата
Общие затраты на сертификацию пропорциональны классу медицинского изделия. Чем выше класс, тем выше риск и сложнее процесс получения сертификата.
Стоимость сертификации медицинского изделия в ЕС складывается из следующих затрат:
аудит технического файла медицинского изделия (за исключением нестерильных одноразовых изделий I класса);
выпуск СЕ сертификата (для изделий класса IIa и выше) и сертификата СМК;
Таким образом назвать предварительную стоимость получения СЕ сертификата можно только после изучения имеющихся документов медицинского изделия. На стоимость могут также повлиять пожелания заказчика относительно выбора нотифицированного и сертификационного органов.
Свяжитесь с нами и сообщите, на какое медицинское изделие вы планируете оформить CE сертификат, и мы бесплатно рассчитаем стоимость. Просто позвоните нам или пришлите сведения с помощью одной из форм обратной связи.
Правила нанесения CE маркировки на медицинские изделия
Регламентами установлены очень четкие правила нанесения СЕ маркировки. Главные требования к CE маркировке приведены в Приложении V и статье 20 Регламента MDR 2017/745:
Маркировка должна быть нанесена видимым, разборчивым и нестираемым образом (печать, гравировка, теснение и пр.) на изделие или его стерильную упаковку. Если такая маркировка невозможна или ее сохранность сложно обеспечить, маркировка СЕ должна быть нанесена на упаковку изделия. Маркировка CE также должна присутствовать в любых инструкциях по применению (руководствах по эксплуатации) и на любой потребительской упаковке;